Skyldig eller ikke skyldig
Radikalisering
– Når vi fordeler skyld i denne sammenhengen, er det stoffers evne å opptre uventet, nemlig deres evne til å danne frie radikaler. Frie radikaler er definert som uparede elektroner, elektroner liker å opptre parvis og alene blir de i ubalanse. Stoffer med frie radikaler er uberegnelige, både mer reaktive, potensielt mer skadelige og samtidig mer spennende for blant annet kreftbehandling og solcellepanel. Og nå har vi altså funnet en metode for å påvise skyld og radikalisering, smiler Sumit Ganguly som har tatt en doktorgrad på temaet.
Uttrykket skyldig/ikke skyldig ble introdusert av forsker, C.K. Jørgensen i Sveits i 1966. Han fant da at tilsynelatende uskyldige forbindelser med veldefinert plassering av elektroner og atomer under gitte betingelser likevel kan vise seg å være skyldige i elektron-kaos og skape frie radikaler.
Men det var ikke fordeling av skyld og uskyld som var Ganguly’s mål da han startet på sitt forskningsprosjekt. Han poengterer på at arbeidet hans regnes som ren grunnforskning, men at stoffene han har forsket på i aller høyeste grad har funnet sin anvendelse i samfunnet og at såkalt «skyldige» forbindelser byr på nye anvendelser fordi de er veldig reaktive.
Han har studert et sett unike molekyler, nærmere bestemt corroler, nært beslektet med porfyriner. Porfyriner deltar blant annet i naturens eget solcellebatteri i fotosyntesen, binder oksygen i blodet vårt, deltar i metabolisme og medisinopptak i leveren og er i det hele tatt essensielle molekyler for liv på jorden.

Corrol, porfyrinets tvilling
Forskerne begynte med syntese av porfyrinets tvilling, corrolen på 60-tallet, men produksjonen var komplisert. Ikke før teknikkene for syntese av corrol ble kraftig forbedret på 90-tallet, gikk anvendelsen av disse stoffene med unike egenskaper til værs.
Corroler brukes i solcellepanel, til katalyse av ulike kjemiske og biologiske prosesser, i gass- og pH-sensorer, «fargelegging» av cellekomponenter til medisinske bilder og til fototerapi i kreftbehandling.
Edderkoppnett
Ganguly designet og produserte hele 50 nye forbindelser og forklarer ivrig hva som gir corroler deres unike egenskaper. Forbindelsene er kjennetegnet ved at de danner et fint nett av ringformede strukturer, ikke ulikt et edderkoppspinn og sentralt plassert i midten av edderkoppspinnet finnes et metall-atom som utgjør molekylets reaksjonssenter.
Reaksjonssenterets effektivitet og funksjon er strengt regulert av hvordan elektroner orienteres i edderkoppnettet rundt senteret.
– Jeg har blant annet koblet opp ulike kjemiske grupper i ytterkant av edderkoppspinnet, byttet ut metallet i midten og sett på hvordan det har påvirket elektronmønsteret og reaksjonssenteret. Reaksjonssenteret ble testet med ulike metallatomer som Mangan, Jern, Cobolt og Rhodium. Noen av disse konstruksjonene dytter elektroner inn mot sentrum og noen trekker elektronene ut i periferien. Om vi dytter elektroner inn mot midten medfører det at reaksjonssenteret reagerer lettere og samtidig blir en mer effektiv katalysator, forklarer kjemikeren.
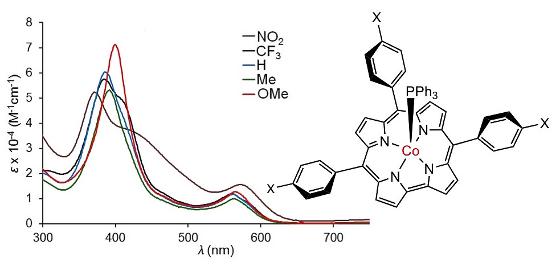
Fargerike forbindelser
I kartleggingen av de nye forbindelsene brukte han UV-lys spektroskopi, en metode som er mye brukt til å finne sammensetningen av kjemiske stoffer som absorberer lys.
Corroler og porfyriner er mestere lysabsorpsjon og finnes i alle regnbuens farger, de absorberer altså lys med ulik bølgelengde og nettopp det kan avsløre deres oppbygning.
Løste gåten
Ganguly forteller at han underveis i arbeidet sitt oppdaget at de kunne bruke spektroskopianalysene for å skille på corroler med et velorganisert sentrum der elektronene hadde sin definerte plass, og de som hadde et sentrum preget av kaos og løse radikaler på avveie.
– Vi har for eksempel påvist at tilstanden til et jernatom bundet i midten av corrolen er annerledes enn alle forskerne har trodd. Forskere verden over studerer corroler og porfyriner med Jern i sentrum og det har vært en gåte hvordan elektronene her er organisert. Vi trodde de var uskyldige (Fe4+), men vi har nå vist at tilstanden kan beskrives som Fe3+ pluss en fri radikal.
– Vi kan nå på en enkel måte klassifisere veldig reaktive forbindelser, altså skyldige forbindelser og med det kunne si noe hvilke stoffer som har best potensiale innen katalyse og for eksempel fungere best til medisiner og solcellepanel, oppsummerer Ganguly.
Sumit Ganguly disputerte 30. november 2017 med oppgaven: “Ligand Noninnocence In Manganese, Iron, and Cobalt Corroles”. Han ble veiledet av Abhik Ghosh, Institutt for kjemi ved UiT-Norges arktiske universitet.
---------------------------------------------------------------------------------------
Les mer:
Her får metaller magiske evner (UiT nyhetsak, 2016)
Ligand Noninnocence In Manganese, Iron, and Cobalt Corroles (Doktorgradsavhandling, Munin, UiT sitt vitenarkiv)
Corrole-based applications (Feature article ChemComm, 2007)