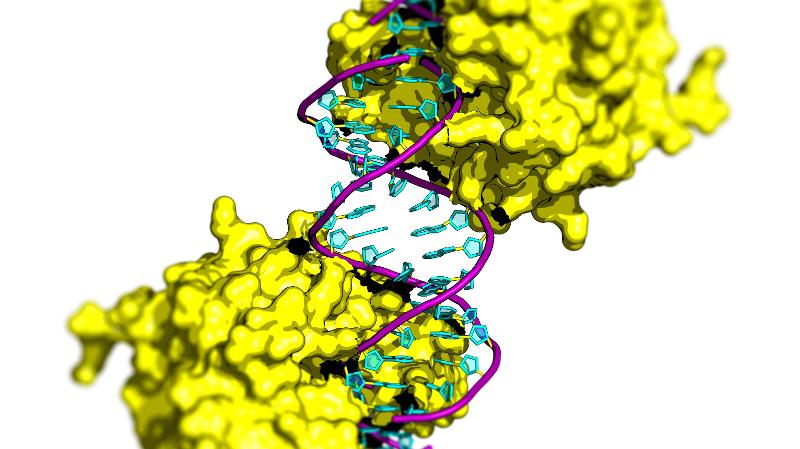
Skrur opp ladningen for å trekke til seg DNA
Ettertraktede egenskaper
Kuldetilpassede enzymer har egenskaper som industrien etterspør. Vaskemiddelprodusenter og matindustri vil ha enzymer som kan drive prosesser med lav varme både for å spare strøm og for å få høyere kvalitet på sine produkter. Innen molekylærbiologisk forskning på universiteter og sykehus er man også på jakt etter molekyler hentet fra kalde miljø fordi funksjonen til slike enzymer enklere kan kontrolleres i forsøkene.
-Det har tidligere vist seg at enzymer fra organismer som lever ved temperaturer ned mot frysepunktet er mer effektive og samtidig mer ustabile enn sine normaltempererte slektninger, forklarer Michetti

Kjemikeren har nylig tatt en doktorgrad der han har sammenliknet to nesten identiske enzymer med opprinnelse fra to bakterier fra habitat på hver sine ende av temperaturskalaen.
-Jeg utforsket detaljer i enzymenes oppbygning for å finne nøyaktig hvilke deler av enzymet som gir dem de spesielle egenskapene.
«Editerer» DNA
Enzymene han har forsket på deltar i editering av DNA tråden; Endonuklease klipper opp DNA hos Aliivibrio Slamoniciada og Vibrio Cholerae, to sykdomsfremkallende bakterier, førstnevnte tilpasset kulde og den andre tilpasset varme omgivelser.
Aliivibrio Slamoniciada fremkaller sykdom hos laks og trives godt rundt 4 grader celsius mens Vibrio Cholerae kan smitte mennesker og vokser i temperaturer opp til 40 grader celsius. Men det er ikke deres sykdomsfremkallende evner Michetti har forsket på.
-Vi har brukt Endonuklease fra disse to bakteriene fordi vi kjenner oppbygningen deres i detalj, og kan derfor studere hvordan de enkelte aminosyrene og atomene er plassert.
Fant forskjeller på overflaten
Michetti forklarer at overflaten på det kuldetilpassede enzymet i større grad enn det varmetilpassede er satt sammen av komponenter som er løsere pakket og har en netto positiv ladning og at det synes å ha en tiltrekkende kraft på det negativt ladede DNA molekylet. Kuldetilpasset endonuklease bruker altså sin tiltrekningskraft kombinert med «flagrende» overflatemolekyler til å dra til seg DNA-molekylet som skal klippes og effektiviserer dermed arbeidsoppgaven sin.
Både eksperimentelle forsøk med røntgenkrystallografi, kvantemekanikk og molekyldynamikk i form av datasimuleringer, ligger til grunn for hans resultater.
-Vi hadde delvis forventet at reaksjonssenteret på enzymet skulle være nøkkelen til denne forskjellen i effektivitet, men ifølge våre resultater er det altså overflaten av molekylet som kompenserer for kulde og gjør det mer effektivt, oppsummerer Michetti.
Michettis arbeide ble finansiert av Forskningsrådet og High performance computing group, UiT. Han ble veiledet av Bjørn Olav Brandsdal, Institutt for kjemi, UiT-Norges arktiske universitet og var tilknyttet Center for beregningsbasert kjemi - CTCC og forskerskolen BioStruct.